昆明理工大学生命科学与技术学院张传茂教授团队与北京大学等机构合作,揭示了核膜出芽促进衰老的机制及ERK1/2持续性激活在抗衰老中的作用。2024年10月1日,相关研究成果以Nuclear envelope budding inhibition slows down progerin-induced aging process为题在线发表于国际著名学术期刊、美国科学院院报Proceedings of the National Academy of Sciences。

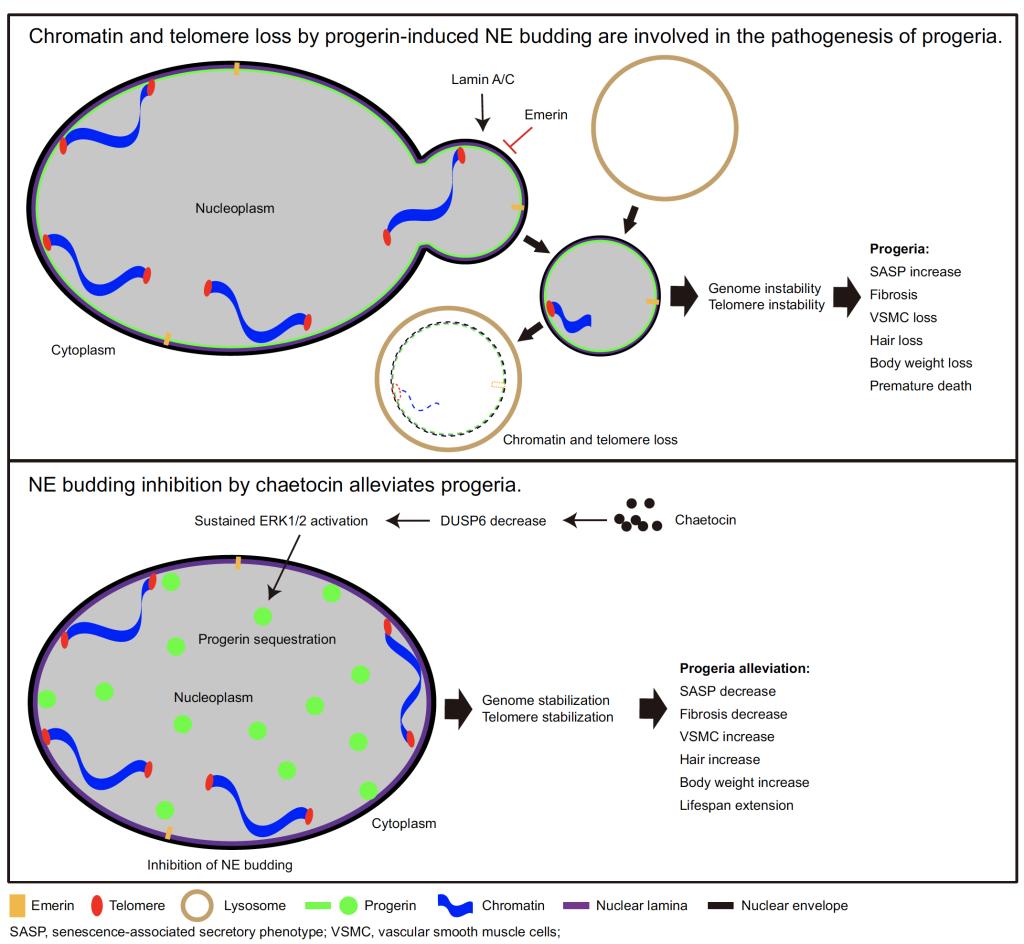
该研究阐明了核膜出芽(nuclear envelope budding)介导的染色质丢失、端粒丢失促进衰老的分子机制,进一步通过高通量筛选鉴定到核膜出芽抑制剂毛壳素 (chaetocin) ,并揭示了chaetocin通过持续性激活ERK1/2来扰乱progerin的核膜定位,进而抑制核膜出芽。该研究揭示了核膜出芽在衰老中的作用以及chaetocin和ERK1/2持续性激活在抗衰老中的作用,为早老症以及衰老相关疾病的干预提供了新思路。
基因组不稳定(genomic instability)、端粒磨损(telomere attrition)、表观遗传改变(epigenetic alterations)等是公认的衰老标志,探究衰老的调控机制不仅有助于了解衰老的本质,还将为衰老相关疾病的诊疗提供理论依据。人类早老症(Hutchinson–Gilford progeria syndrome)是一种罕见的、系统加速性衰老疾病,90%的早老症患者是由早老蛋白progerin的表达所引起。早老症患者表现出脱发、皮肤皱缩、皮下脂肪缺失、动脉粥样硬化等症状(https://rarediseases.info.nih.gov/diseases/7467/progeria),与正常衰老个体的表现极为相似。因此,近年来早老症模型越来越多地被用于衰老机制的研究。
张传茂教授团队通过分离早老症患者和小鼠模型的原代皮肤成纤维细胞(primary dermal fibroblasts),并结合小鼠肝脏、心脏、肾脏的病理切片分析,发现早老蛋白progerin诱导了核膜出芽,促使细胞和个体衰老;同时发现核纤层蛋白lamin A/C协助progerin而促进该出芽过程,而内层核膜蛋白emerin则抑制该出芽过程。该核膜出芽过程,能够介导染色质和端粒等物质向细胞质转运,然后被溶酶体途径降解,从而引起基因组和端粒不稳定,进而加速细胞和个体衰老。进一步研究发现,早老蛋白progerin的核膜定位是引起核膜出芽的先决条件,而扰乱progerin的核膜定位,可以有效地抑制核膜出芽过程。因此,通过建立基于progerin亚细胞定位的高通量筛选体系,本项研究成功地鉴定出天然产物chaetocin可以显著地抑制progerin在核膜上的定位和核膜出芽,从而缓解染色质和端粒丢失,抑制细胞和个体衰老进程。通过小鼠实验,发现chaetocin可以抑制组织器官衰老相关性分泌表型(Senescence-Associated Secretory Phenotype,SASP)基因的表达,缓解早老症小鼠的脱发、血管平滑肌丢失、组织器官纤维化等症状,显著地延长早老症小鼠寿命。进一步的机制探究,发现chaetocin通过持续性激活ERK1/2信号通路而扰乱progerin的核膜定位,进而抑制核膜出芽过程,从而解析了ERK1/2持续性激活在抗衰老中的作用机制。
昆明理工大学张传茂教授为本论文的通讯作者,北京大学王向阳博士、北京儿童医院皮肤科马琳主任为本论文的共同第一作者。清华大学陆娣博士、北京大学赵淦博士和任合博士为本论文作出了重要贡献,北京儿童医院李巍教授、清华大学俞立教授、北京大学陈建国教授和张博教授为本论文提供了指导和帮助。该项研究工作获得了国家科技部、国家自然科学基金委、北京大学、昆明理工大学等机构的基金项目支持。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2321378121
(供稿:生科学院)